- A+
本期是关于分子模拟在开发高效低风险农药研究领域的应用,内含ECD计算、同源模建、分子对接等多项技术的综合应用,收录在【殷赋案例】专辑中。
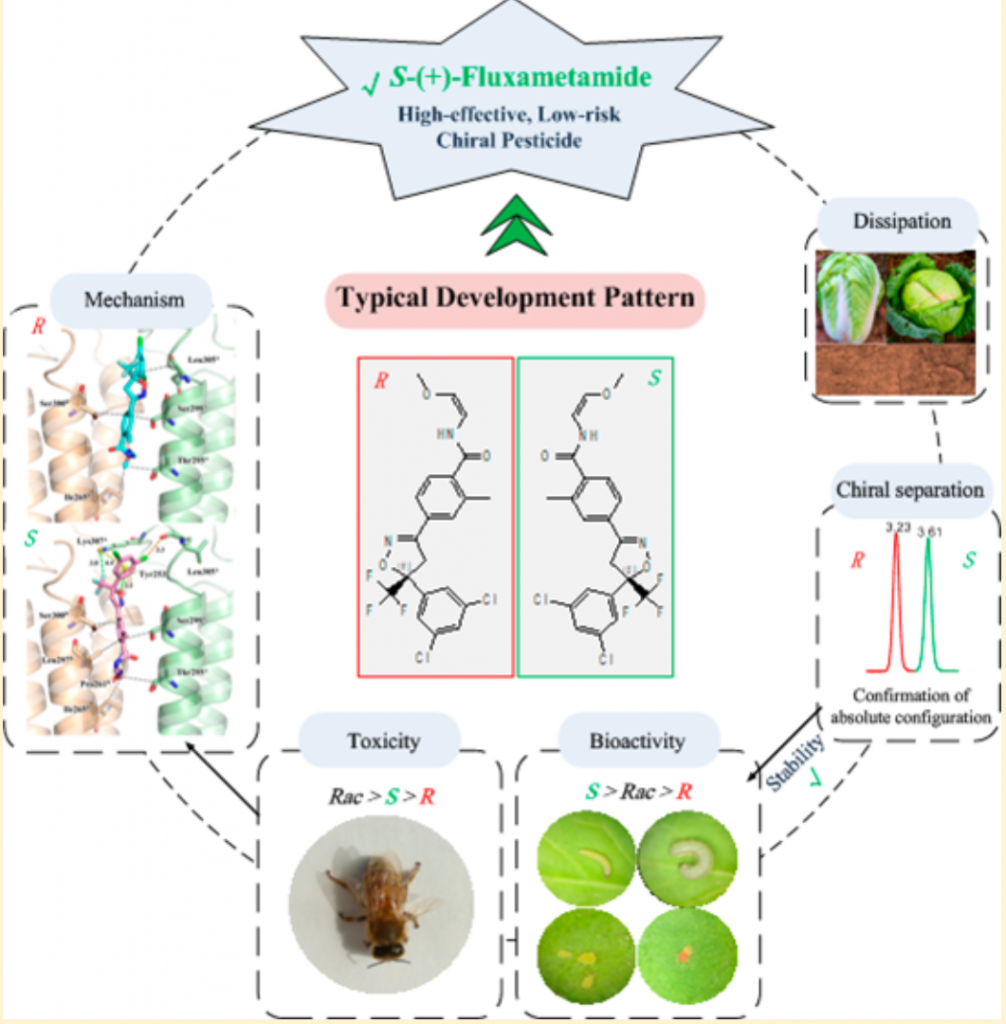
手性农药占现代农药的30%,大部分手性农药都是以外消旋混合物的形式生产的。然而,手性农药会因为对映体与生物手性分子(蛋白)的相互作用而表现出不同的生物学性质(活性,bioactivity;毒性,toxicity;残留行为,dissipation behavior;生物代谢,biological metabolism)。效率较高的对映体对非靶标生物的毒性可能较小。因此,鉴定和开发单一对映体产品可以提高农药的效率,降低环境风险和环境污染。
中国农业科学院植物保护研究所农药残留与环境行为研究组郑永权研究员团队从手性对映体的角度切入,系统开展了新型杀菌剂氟噁唑酰胺对映体的分离、制备及其稳定性评估,揭示了其残留化学行为、对靶标生物活性、对非靶标生物的毒性差异及其分子机制。为开发高效低风险的农药和减量施用农药提供了新的途径。
氟噁唑酰胺,是一种新型的配体门控氯离子通道(Ligand-gated Chloride Channel,LGCC)拮抗剂,属于外消旋异恶唑啉类杀虫剂,主要作用于害虫的γ-氨基丁酸门控氯离子通道(γ-aminobutyric acid-gated chloride channel ,GABACls),对鳞翅目、粉虱、双翅目等多种害虫具有广谱生物活性。研究者首先建立了氟噁唑酰胺对映体的分离及半制备方法,确认了两个对映体在环境条件下的单体稳定性,然后以4种靶标害虫为对象,对氟噁唑酰胺的生物活性和毒性进行了实验。初步结果表明,该农药的杀虫活性主要来自于S-(+)-氟噁唑酰胺,其对4种靶标生物的活性是消旋体的2.5~3.7倍。而消旋体氟噁唑酰胺对非靶标生物的毒性最高,为S-(+)-氟噁唑酰胺的4.3倍。基于这些发现,研究人员通过分子对接方法结合同源模建技术解析了氟噁唑酰胺对映体选择性活性和毒性差异机理,明确了氟噁唑酰胺在蔬菜和土壤中的选择性降解行为。研究建议研发S-(+)-氟噁唑酰胺,提高药效的同时可有效降低对非靶标生物的风险,为基于对映体水平开发高效低风险农药提供了新途径。
下文针对计算内容中的ECD方法和分子对接结合同源建模解析展开介绍。
电子圆二色谱(ECD)
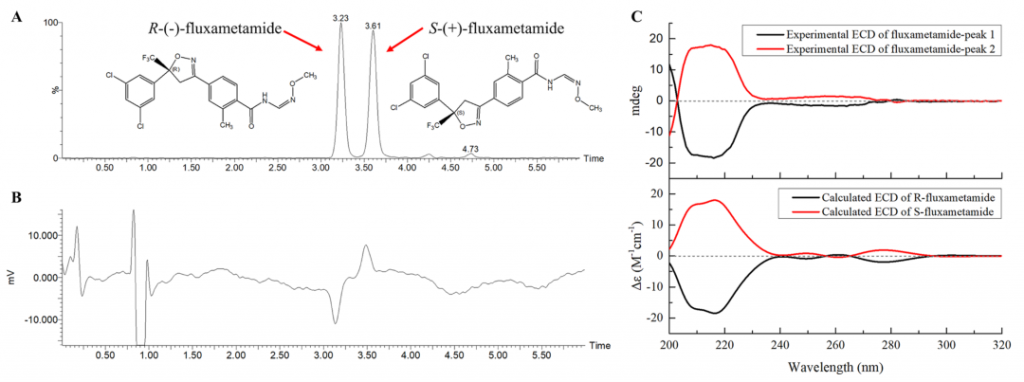
研究者先用实验方法测定了氟噁唑酰胺对映体的旋光度(ORs)和绝对构型,然后在殷赋云平台(https://cloud.yinfotek.com/)采用含时密度泛函理论(TD-DFT)计算了氟噁唑酰胺对映体的电子圆二色谱(ECD),并利用Gaussian 09软件对其几何构型进行了优化。通过比较实验ECD谱和预测的ECD谱,研究人员确定了氟噁唑酰胺对映体的绝对构型。如图1所示,实验ECD谱与计算谱高度相似,波长200到240nm范围内呈现出对应的科顿效应(Cotton Effect,CE),这是直线偏振光透过旋光性物质时产生偏转的现象。因此,氟噁唑酰胺对映体在手性柱上的洗脱顺序为R-(-)-氟噁唑酰胺和S-(+)-氟噁唑酰胺。
分子对接结合同源建模解析
为了从分子水平上研究氟噁唑酰胺对映体与害虫GABAR结合方式的差异,研究者采用殷赋云平台 (https://cloud.yinfotek.com/)DOCK 6 分子对接方案进行了分子模拟。
分子对接结合同源建模操作简述
1. 从UniProt数据库检索蛋白P. xylostella (UniProt ID:C0L7I7)记录。
2. 利用SWISS-MODEL在线蛋白质结构预测服务器(http://swissmodel.expasy.org/)进行同源模建,以人源GlyRα3的晶体结构(PDB code: 5VDH)为模板构建P. xylostella GABAR的三维结构。
4. 在殷赋云平台上绘制氟噁唑酰胺的结构,通过MMFF94力场能量最小化,获得良好的三维结构。
5. 以5VDH的跨膜亚基界面(TSI)上的共晶配体伊维菌素的结合位置定义对接口袋。
6. 采用DOCK 6计算方案进行半柔性对接,分析结合模式。
计算结果表明,对映体的对接打分与生物活性趋势一致。如图2,两者均结合在 GABAR 蛋白相同位置,但立体构型使两者的结合模式具有明显差异:S构型与Leu305形成卤键,与Lys307形成氢键和阳离子-π相互作用,与Tyr253形成氢键,因此提供了显著的静电贡献,而R构型无法形成相应作用力。

上述分析结果表明S构型与受体蛋白结合形成更多的相互作用,比R构型具有更强的 GABAR 结合亲和力,与实验结论一致。此外,实验测得外消旋体构型Rac-氟噁唑酰胺的生物活性值介于两个对映体之间,可以从对接结果获得解释。外消旋体是一种具有旋光性的手性分子与其对映体的等摩尔混合物。外消旋体的生物活性/毒性(结合力)实际上是两对映体的平均值。因此,上述对接结果及其平均值完美对应生物活性顺序:S-(+)氟噁唑酰胺>Rac-氟噁唑酰胺>R-(-)-氟噁唑酰胺。
图2的结果还显示,氟噁唑酰胺在通道的内区与跨膜亚单位界面(TSI)结合,而伊维菌素在通道的外部与谷氨酸门控氯离子通道(GluCls)的TSI结合。这一项发现与文献中的报道一致,氟噁唑酰胺与配体门控氯通道(LGCCs)的TSI结合,但在TSI中的作用方式与包括伊维菌素在内的大环内酯类药物不同。

受试对象靶标害虫P. xylostella GABAR和非靶标生物A. mellifera GABAR的序列比对结果如图3所示,两者在结合口袋中的贡献残基(标记在绿色框中)都是相同的。这说明P. xylostella GABAR的分子对接结果具有代表性和适用性,验证了GABA与S(+)-氟噁唑酰胺的亲和力较强,同时也导致实验中S-(+)-氟噁唑酰胺对非靶标生物的毒性大于R-(−)-氟噁唑酰胺的结果。
本研究从手性对映体水平系统开展了新型杀菌剂氟噁唑酰胺对映体的分离、制备及其稳定性评估,揭示了其残留化学行为、对靶标生物活性、对非靶标生物的毒性差异及潜在分子机制。为手性农药的合理开发和安全使用提供了重要的技术支持。该成果已经发表在学术期刊Environmental Science & Technology(5年IF:7.874)上。





