- A+
本期是关于分子对接在双酚类似物和牛血清白蛋白相互作用研究中的应用,收录在【殷赋案例】专辑中。

双酚是生产聚碳酸酯和环氧树脂等材料时使用的一大类化学品。其中,应用最广泛的双酚A(BPA)被公认为内分泌干扰物之一,具有体内、外毒性。它的类似物(如BPB、BPC、BPM、BPP、BPZ和BPAP,统称BPs)也会对健康产生负面影响。血清白蛋白(Serum Albumin,SA)是循环系统中最主要的载体蛋白之一,具有结合和运输内源性与外源性物质到细胞和靶组织的功能。BPs进入血液后与SA结合,会引起蛋白质的结构变化,影响蛋白质的正常功能和生物活性,产生毒性反应。其结合亲和力影响着它在体内的代谢过程。
渤海大学化学与化学工程团队以牛的血清白蛋白(Bovine Serum Albumin,BSA)为模型转运蛋白,采用实验结合分子对接的方法,开展了双酚类似物(BPs)与牛血清白蛋白(BSA)的相互作用机制研究,深入探究了BPs在血液转运过程中对载体蛋白的蛋白质构象的影响。本研究在环境毒理学和临床医学领域具有重要意义。
研究者首先采用多光谱分析实验发现BPs相较于BPA对BSA具有更强的亲和力,并能引起更大的BSA构象变化。BPs之间具有相同的骨架结构(双酚),因此它们与BSA相互作用时所表现出的结合力、自发结合反应、结合位点数和构象变化等方面都具有相似性。不同之处在于,这些BP之间的结构差异影响了它们与BSA的疏水结合过程和牛血清白蛋白的二级结构和微环境极性。根据这些发现,研究者推断BPs-BSA的结合亲和力和BPs分子间的结构差异是影响结合过程和BSA构象变化的主要因素,这对于了解BPs在血液转运过程中分布、扩散和代谢非常重要。
为进一步了解BPs与BSA的相互作用机制,研究者采用殷赋云平台(https://cloud.yinfotek.com/) 分子对接方案模拟了BPs的分子结构,预测出它们与BSA的结合亲和力和主要结合部位。
操作简述
1. 准备配体分子:绘制BPs的化学结构,在MMFF94力场中能量最小化,获得三维结构;
2. 准备受体蛋白:输入BSA的PDB编号(4F5S),修复残基问题,获得三维结构;
3. 用晶体配体来定义结合口袋;
4. 用DOCK6.9执行半柔性对接;
5. 通过网格评分功能对输出姿势进行评估。
下图左侧显示了BSA的两个结合位点,右侧展示了BPs和BSA结合时的最佳构象。BPs的亲脂性使它们更容易与BSA疏水空腔结合,由此推断BPs与BSA疏水口袋的结合程度与其亲脂性密切相关。配体与受体之间主要结合力为疏水相互作用,这与实验部分的结果一致。

在位点I,有BPA/BPAP/BPM/BPP/BPZ/DES/DS与BSA结合。如下图所示,BPZ与BSA的His 241残基形成氢键作用。BPAP与Aarg 217和Arg 194残基产生π-阳离子相互作用,因此可以克服苯环的空间位阻,具有很强的结合亲和力。DS与Arg 198残基具有π-阳离子相互作用(而DES没有),这解释了DS和DES具有相似的结构,但DS与牛血清白蛋白的结合亲和力高于DES与牛血清白蛋白的结合亲和力。
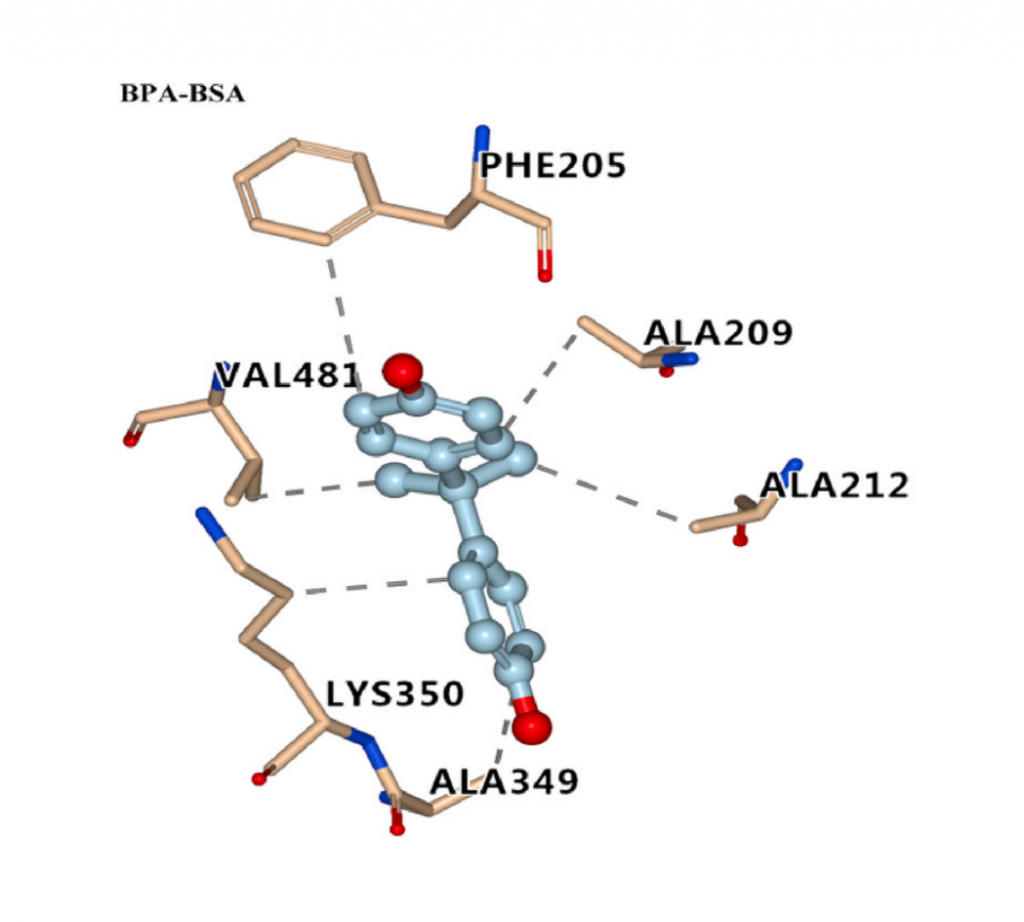
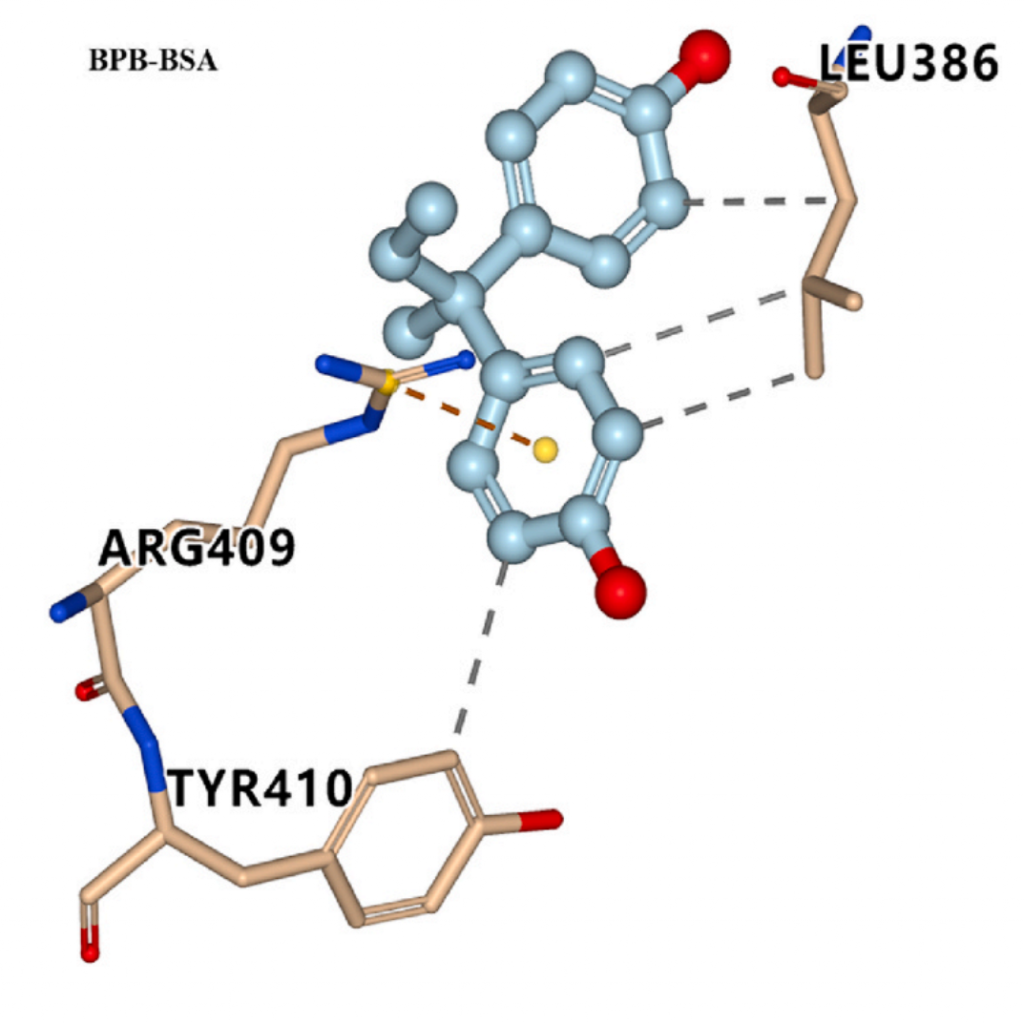
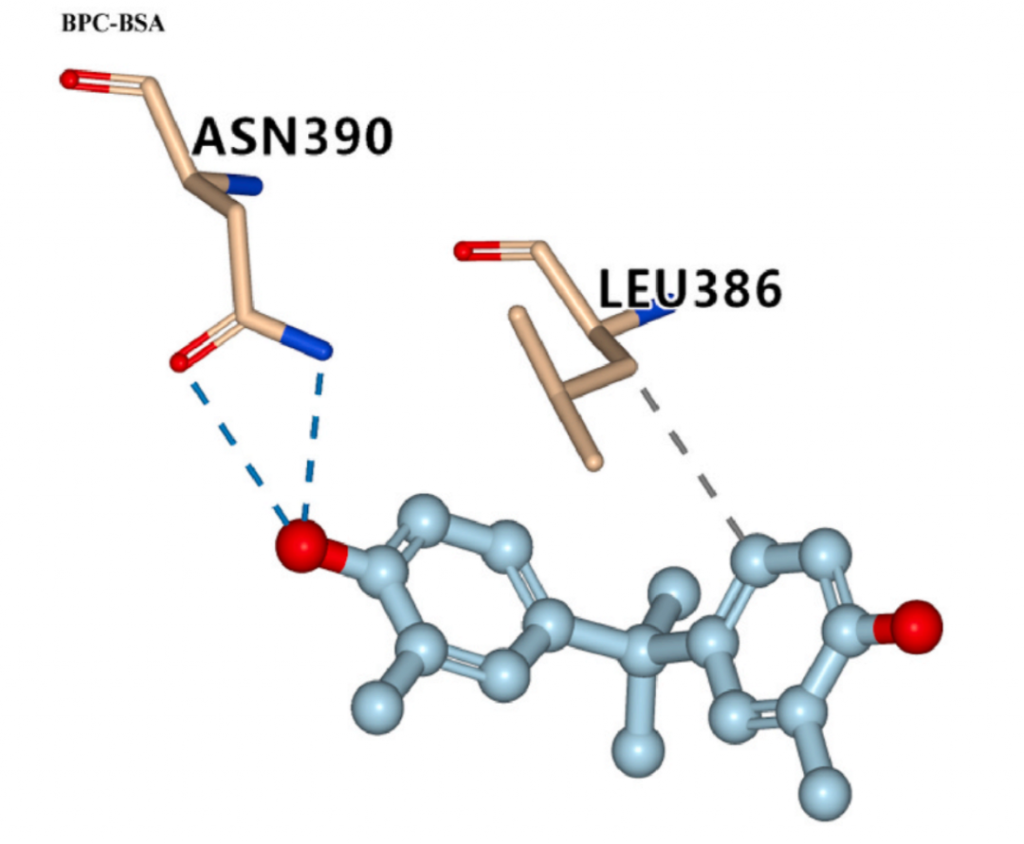
在位点II,有BPB/BPC与BSA结合,BPC与BSA的Asn 390残基形成氢键,这解释了它们结合亲和力强的原因。
从上述研究结果,我们可以看到分子对接方法能够预测出配体分子(双酚A类似物BPs)与靶标(牛血清白蛋白BSA)的可能结合构象,直观地描绘出配体与靶标口袋内残基的相互作用细节,进而阐明它们的相互作用机制,为后期进行新型双酚结构优化打下基础。
本研究通过研究BPs和BSA的构效关系,深入探讨了两者之间的结合机制,实验和计算模拟结果相得益彰,为新型双酚的应用研发和潜在内分泌细胞的识别提供了参考,在环境毒理学和临床医学领域具有重要意义。该成果已经发表在学术期刊Chemosphere上。





